¡Degradad, degradad las oncoproteínas! PROTACs, una nueva estrategia para acabar con las células cancerosas
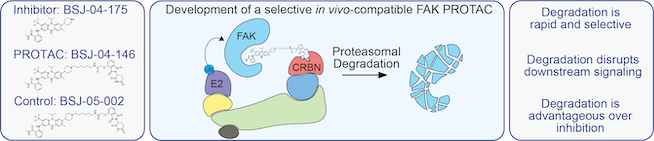
La degradación de proteínas dirigida, que es una estrategia para destruir proteínas cancerígenas, se ha convertido en los últimos años en una de las áreas más candentes en el descubrimiento de fármacos. Las pequeñas moléculas conocidas como PROteolysis-Targeting Chimeras (PROTAC) utilizan el mecanismo propio de nuestras células para reciclar proteínas, el sistema ubiquitina-proteasoma (UPS), para eliminar las proteínas no deseadas. Normalmente, el UPS modifica una proteína con múltiples copias de una pequeña proteína reguladora conocida como ubiquitina. La proteína ubiquitilada es reconocida por el UPS y degradada. Los PROTAC son una estrategia poderosa para redirigir el UPS para degradar las proteínas a voluntad. Por lo general, un PROTAC se compone de dos ligandos unidos por un conector: un ligando recluta y se une a la proteína objetivo, mientras que el otro recluta y se une al complejo de ubiquitina ligasa, lo que conduce al marcaje de la proteína objetivo con ubiquitina. Una vez que la proteína objetivo ha sido marcada con ubiquitina, UPS la degrada como lo haría con cualquier otra proteína ubiquitilada.
Este enfoque es particularmente atractivo en el desarrollo de fármacos dirigidos a proteínas quinasas que estimulan la tumorigénesis a través de sus mecanismos catalíticos y de andamiaje. Por ejemplo, la cinasa de adhesión focal (FAK) es una tirosina cinasa citoplasmática no receptora con funciones nucleares y de andamiaje que desempeña un papel importante en muchos procesos celulares. En muchos tipos de cáncer, incluido el cáncer de páncreas y de mama, la FAK se sobreexpresa, lo que conduce a una mayor proliferación, migración y adhesión celular a través de mecanismos posteriores. Hasta la fecha, el campo se ha centrado en gran medida en el desarrollo de inhibidores de molécula pequeña de la actividad de la quinasa FAK como agentes terapéuticos contra el cáncer. En una publicación reciente en ChimBioChem, el Dr. Behnam Nabet, profesor asistente en la División de Biología Humana, y su equipo adoptaron un enfoque diferente y desarrollaron un FAK PROTAC selectivo, denominado BSJ-04-146. «Se han desarrollado varios inhibidores de FAK que, lamentablemente, han mostrado una eficacia limitada en ensayos clínicos como terapias contra el cáncer», dijo el Dr. Nabet. «Estos inhibidores se dirigen a las actividades enzimáticas de FAK y no interrumpen sus funciones no enzimáticas». A diferencia de los inhibidores de cinasas tradicionales, los PROTAC pueden eliminar las funciones catalíticas y de andamiaje, lo que proporciona una estrategia novedosa para atacar las oncoproteínas. El Dr. Nabet tiene como objetivo utilizar PROTAC para «interrumpir todas las funciones FAK necesarias para mejorar las respuestas contra el cáncer».
Inicialmente, el Dr. Nabet y su equipo conjugaron el inhibidor de FAK VS-4718 con un ligando de reclutamiento de ubiquitina ligasa y probaron su capacidad para degradar FAK en líneas celulares de adenocarcinoma ductal pancreático (PDAC). Aunque los PROTAC conjugados con VS-4718 degradaron FAK, también mostraron efectos fuera del objetivo en varias quinasas importantes. Por ejemplo, BSJ-03-136 causó una degradación significativa de FAK y una disminución de la fosforilación de AKT, un objetivo posterior de FAK, así como quinasas agotadas como WEE1 y AURKA. Para mejorar aún más la selectividad de estos FAK PROTAC, los autores realizaron un diseño guiado por estructura para mejorar el perfil de direccionamiento de quinasa de VS-4718, produciendo BSJ-04-175. Este inhibidor demostró una gran especificidad hacia FAK en comparación con VS-4718 y BSJ-03-136.
Para comparar las respuestas biológicas a la inhibición de FAK con la pérdida completa de FAK, los autores convirtieron BSJ-04-175 en FAK PROTAC, denominado BSJ-04-146. La degradación de FAK fue inducida por BSJ-04-146 a dosis tan bajas como 10 nM y mostró un impacto funcional significativo en la señalización de FAK aguas abajo. Los efectos se observaron tan pronto como una hora después del tratamiento. A diferencia de los PROTAC conjugados con VS-4718, BSJ-04-146 no indujo la degradación de la quinasa fuera del objetivo y fue notablemente selectivo. Además, los autores evaluaron los cambios en el fosfoproteoma tras la degradación de FAK frente a la inhibición de FAK. La degradación de FAK dio como resultado cambios significativos en el fosfoproteoma, que no se observaron cuando se inhibió FAK. Estas observaciones son consistentes con la idea de que FAK funciona como una enzima y como un andamio de proteínas. Usando BSJ-04-146, los autores demostraron que la degradación de FAK mostró una disminución marcadamente mejorada en la proliferación de células de cáncer de mama y páncreas cultivadas como esferoides 3D, así como la migración de células de cáncer de mama, en comparación con los inhibidores de FAK. Finalmente, se probó la capacidad de BSJ-04-146 para degradar FAK en modelos de ratón. De manera emocionante, el Dr. Nabet y su equipo confirmaron que BSJ-04-146 exhibe una degradación significativa de FAK vivir. El trabajo del Dr. Nabet ha demostrado que “apuntar a la degradación de FAK conduce a respuestas biológicas mejoradas, en comparación con la inhibición de la actividad de FAK”. La degradación de FAK dirigida es «una estrategia ventajosa que justifica un mayor desarrollo como un enfoque terapéutico novedoso en el cáncer de páncreas», agregó.